- Какво е атом?
- Как е съставен един атом?
- Как се комбинират атомите?
- Части от атом
- История на атома
- Молекула
Обясняваме какво е атом и как е изградена всяка негова част. Също така, неговата история, изследвания за него и какво е молекула.

Какво е атом?
Най-малката единица, която съставлява материя.
Думата атом идва от старогръцки (атом, „Без разделение“) и е измислен от първите философи, които теоретизират за състава на нещата, тоест елементарните частици на Вселената. Оттогава, с появата на атомни модели, начинът на представянето им се е променил изключително много, тъй като атомният модел е наследил предишния през вековете, докато не достигнахме този, който използваме днес.
Атомите имат свойствата на химичен елемент които съставят и от своя страна елементите са организирани и класифицирани според техните атомни числа, електронна конфигурация и химични свойства в Периодичната таблица на елементите.
Един и същ химичен елемент може да бъде съставен от различни атоми от един и същи клас, тоест с един и същ атомен номер (брой на протони които всеки атом има в елемента), въпреки че атомните им маси са различни.
Например, има различни атоми на един и същи елемент, които се различават по броя си неутрони, и те се наричат изотопи, представителен случай са изотопите на елемента въглерод (12C, 13C, 14C). И така, всеки атом принадлежи към един и същ химичен елемент или не, в зависимост от неговия брой протони, така че атомите със същия брой протони принадлежат към един и същ химичен елемент.
Как е съставен един атом?
Атомите са съставени от ядро и един или повече електрони (които имат отрицателен заряд) около него. Ядрото е изградено от частици, наречени протони и неутрони. Протоните са положително заредени, а неутроните са неутрални. Наборът от протони и неутрони се наричат нуклони.
Протоните и електроните се привличат един към друг от електромагнитната сила (взаимодействието на заредените частици с електрически и магнитни полета), докато протоните и неутроните се привличат един към друг от ядрената сила (сила, която изпитват само частиците, които съставляват атомно ядро).
Как се комбинират атомите?
Атомите могат да се комбинират един с друг, за да се образуват химически връзки, какво се случва, когато споделят своите електрони по един или друг начин. Химическите връзки могат да бъдат ковалентен, йонна Й метален, който произхожда от ковалентни молекулни съединения, йонни мрежи или метални съединения (въпреки че е важно да се изясни, че нито една химическа връзка не е абсолютно ковалентна или йонна). По този начин атомите могат да се комбинират, за да се образуват молекули прост като Вода, както и да формира макромолекули сложни като протеин, ДНК Й РНК.
Въпреки че атомите се различават един от друг благодарение на конфигурацията на техните частици, също така е вярно, че всички атоми на един и същи елемент са напълно идентични: водородните атоми в слънце Те са същите като тези, които изграждат нашето тяло, а въглеродните атоми в тялото на кучето са идентични с тези, които съставляват диамант. Разликата е в начина, по който атомите се комбинират, за да образуват различните химични съединения, които изграждат органите и органните системи в живи същества, материалите, генерирани в индустрияи цялата материя, която изгражда вселената.
Части от атом
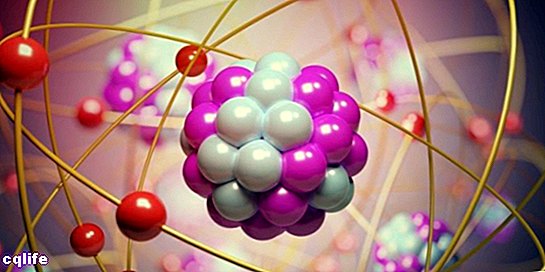
Атомите се състоят от две основни части:
- Ядрото. Около 99,94% от масата на атома е концентрирана в ядрото, където са протоните и неутроните (които заедно се наричат "нуклони"), съединени от силни ядрени сили, което не позволява на протоните, които те се отблъскват един друг, имайки еднакви електрически зареждане.
- Атомните орбитали. Орбитала описва област от пространство, заобикаляща атомното ядро, в която вероятност да се намери електрон е много високо. Тези области имат различни форми, които се получават в резултат на решаването на стационарното уравнение на Шрьодингер. Ервин Шрьодингер е австрийски учен, който разработва това уравнение през 1925 г., за да изчисли еволюцията на субатомна частица, като електроните. Така електроните образуват един вид "облак" около ядрото, което е представено от формата на атомните орбитали. От друга страна, всяка атомна орбитала съответства на определена енергийна стойност за електроните, така че те са организирани според техните енергийни стойности. Следната фигура показва формите на първите атомни орбитали:

История на атома

Първият, който формулира идеята за съществуването на атоми, е гръцкият философ Демокрит (с.V-VI пр. н. е.) от чисто въображаеми спекулации (както се разбира науката по това време).
Неговите изследвания са подхванати от по-късни философи като Левкип и Епикур, но са пренебрегнати през средновековен, засенчена от креационисткото обяснение на света, което приписваше всичко на Бог.
Трябваше да изчакаме до 1773 г., когато френският химик Антоан дьо Лавоазие постулира своята теория за несъздаването или унищожаването на материята (това само трансформира) или Закон за запазване на масата, което позволи на Джон Далтън да формулира първата модерна атомна теория през 1804 г.
Последователни учени на физически и на химия те бяха вдъхновени от работата му да предложат по-добри и по-сложни системи за разбиране на фундаменталните частици на материята. Впоследствие бяха предложени нови атомни модели до най-използваните днес.
Съвременната приета структура е тази, произтичаща от експерименти на Ръдърфорд през 1911 г., заедно с формулировките на Нилс Бор, Шрьодингер и Хайзенберг.
Молекула
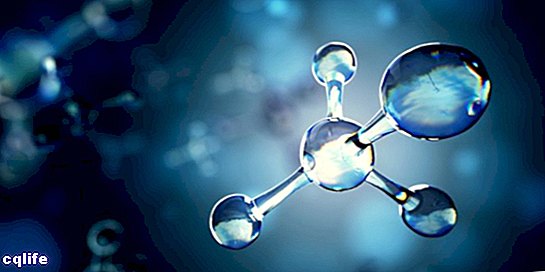
Молекулата е известна като обединението на два или повече атома чрез химични връзки за образуване на по-сложна и електрически неутрална структура. Химическите връзки могат да бъдат ковалентни или йонни.
Молекулите могат да бъдат изградени от атоми на един и същ химичен елемент, например кислородната молекула (O2), или от атоми на различни химични елементи, например молекулата на глюкозата. Едноатомните газове, например хелий (Не), също се считат за молекули.

